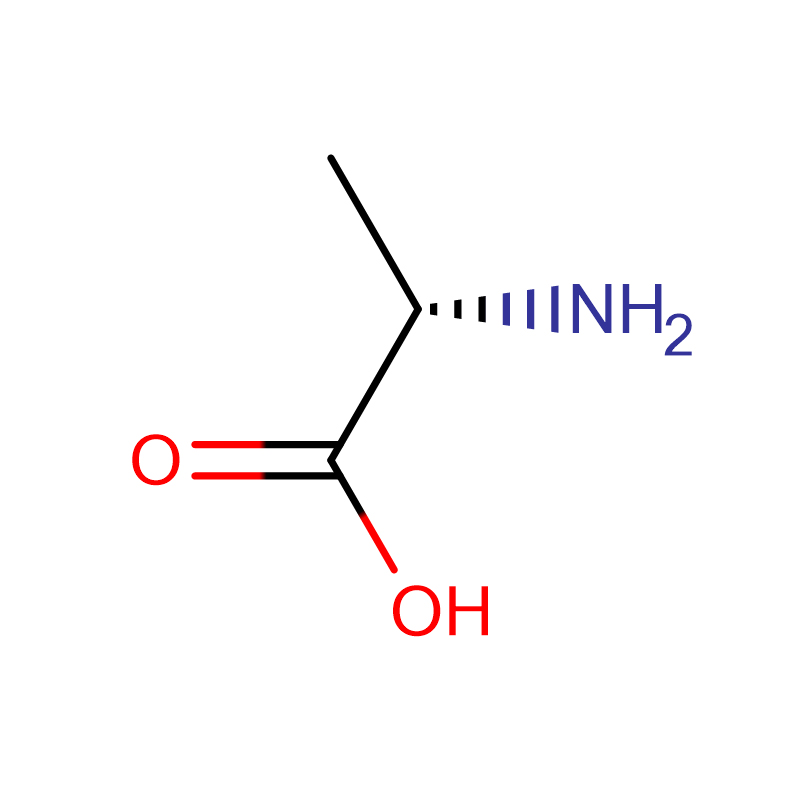
Л-Аланин ЦАС:56-41-7 99% Бели кристални прах
| Каталошки број | КСД90326 |
| Назив производа | Д-аланин |
| ЦАС | 338-69-2 |
| Молецулар Формула | Ц3Х7НО2 |
| Молекуларна тежина | 89.09 |
| Детаљи о складиштењу | Амбијентално |
| Хармонизовани тарифни код | 29224985 |
Спецификација производа
| Изглед | Бели кристални прах |
| Анализа | 98,5 - 101,5% |
| Специфична ротација | +13,7 до +15,1 |
| Тешки метали | <0,0015% |
| pH | 5.5 - 7 |
| СО4 | <0,03% |
| Губитак од сушења | <0,2% |
| Гвожђе | <0,003% |
| Остатак при паљењу | <0,15% |
| Величине честица | 200ум |
| Cl | <0,05% |
| Ниво постојаних органских загађивача | Нема загађивача |
γ-Глутамилтранспептидазе (γ-ГТ) цепају γ-глутамил амидну везу глутатиона и преносе ослобођену γ-глутамил групу у воду (хидролиза) или акцепторске аминокиселине (транспептидација).Ови свеприсутни ензими играју кључну улогу у биосинтези и разградњи глутатиона, као иу детоксикацији ксенобиотика.Овде извештавамо о кристалној структури резолуције 3А Бациллус лицхениформис γ-ГТ (БлГТ) и оној његовог комплекса са л-Глу.Рендгенске структуре потврђују да БлГТ припада Н-терминалној суперфамилији нуклеофилне хидролазе и откривају да протеин поседује отворени расцеп активног места сличан оном који је пријављен за хомологни ензим из Бациллус субтилиса, али различит од оних који су примећени за хумани γ-ГТ и за γ-ГТ из других микроорганизама.Подаци сугеришу да везивање л-Глу индукује преуређење Ц-терминалног репа велике подјединице БлГТ и омогућава идентификацију кластера киселинских остатака који су потенцијално укључени у препознавање металног јона.Улога ових остатака на конформациону стабилност БлГТ је проучавана карактеризацијом аутопроцесирања, ензимске активности, хемијске и термичке денатурације четири нова појединачна мутанта Ала.Резултати показују да замена Асп568 са Ала утиче и на аутопроцесирање и на структурну стабилност протеина.