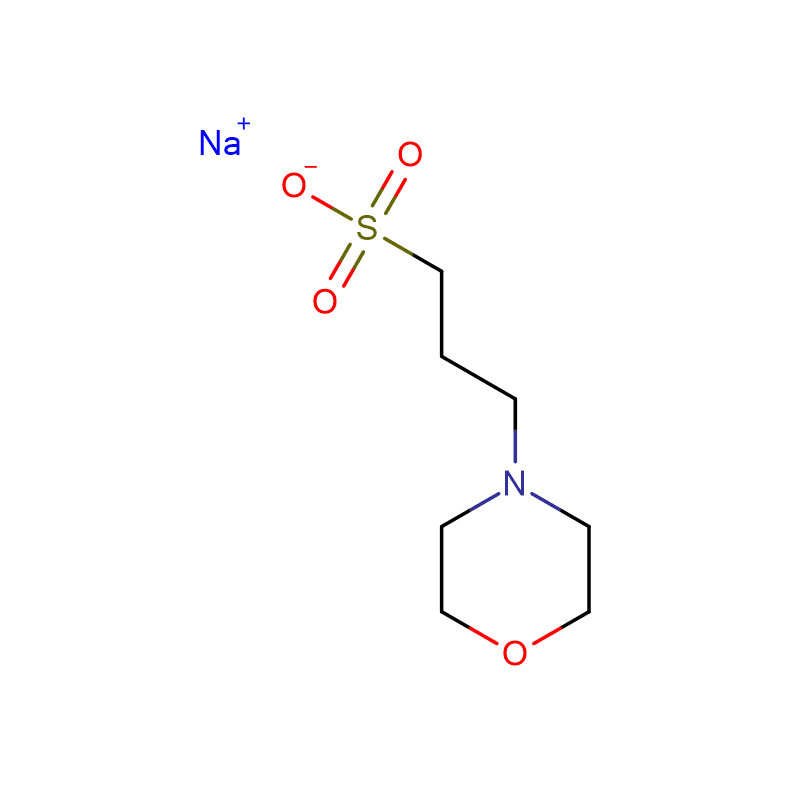
ХЕПБС Цас:161308-36-7 Н-(2-хидроксиетил)пиперазин-Н'-(4-бутансулфонска киселина) Бели кристални прах 99%
| Каталошки број | КСД90100 |
| Назив производа | ХЕПБС |
| ЦАС | 161308-36-7 |
| Молецулар Формула | Ц10Х22Н2О4С |
| Молекуларна тежина | 266.36 |
| Детаљи о складиштењу | Амбијентално |
| Хармонизовани тарифни код | 2933599090 |
Спецификација производа
| Изглед | Бели кристални прах |
| Ассаy | ≥ 99% |
| Температура складиштења | Чувајте на РТ |
| Тачка топљења | 211-216°Ц |
| Коефицијент киселости (пКа) | 8,3 (на 25 ℃) |
Разумемо важност заштите интегритета ваших биомолекула и реагенса са правим пуферским системима.Наши биолошки пуфери обезбеђују стабилност раствора и контролу пХ без мешања у биолошке процесе, и снабдевају критичне соли и хранљиве материје за ћелије и ткива.Наши напредни системи за пуферовање могу вам донети феноменалну стабилност у ћелијској култури, ланчаној реакцији полимеразе (ПЦР), скринингу лекова, биопроцесирању, пречишћавању и апликацијама финалне формулације.Сви наши производи могу се скалирати од раног истраживања до комерцијалних апликација у различитим нивоима пуфера.Нудимо бројне конфигурације паковања, прилагођено мешање, па чак и течне формулације.
Такође испоручујемо свеобухватан избор висококвалитетних биохемикалија у практичном распону квалитета и у разним иновативним, корисничким опцијама паковања.Поред готових производа, нудимо производњу реагенса по мери, мешање и паковање како би задовољили ваше потребе.
Принцип рада и пХ вредност пуферског раствора Када се у неке растворе дода одређена количина киселине и алкалија, то утиче на ометање пХ промене раствора, што се назива пуферски ефекат.Такав раствор се назива пуфер раствор.Мешани раствори слабих киселина и њихових соли (као што су ХАц и НаАц), и мешани раствори слабих база и њихових соли (као што су НХ3·Х2О и НХ4Цл) су пуферски раствори.Пуферски ефекат пуферског раствора састављеног од слабе киселине ХА и њене соли НаА на киселину је последица присуства довољне количине алкалија А- у раствору.Када се у овај раствор дода одређена количина јаке киселине, Х јони се у основи троше А-јонима: тако да је пХ раствора скоро непромењен;када се дода одређена количина јаке базе, слаба киселина ХА присутна у раствору троши ОХ- јоне и омета промену пХ.



![ТАПС-НА Цас:91000-53-2 Течност 99% натријумова со Н-[трис(хидроксиметил)метил]-3-аминопропансулфонске киселине](http://cdn.globalso.com/xdbiochems/91000-53-2.jpg)